Réf. Convergences.online/Hemato ; 2(6) : U14
Montesinos P, Recher C, Vives S, Zarzycka E, Wang J, Bertani G, et al.
Ivosidenib and Azacitidine in IDH1-Mutated Acute Myeloid Leukemia. N Engl J Med. 21 avr 2022;386(16):1519‑31.
Contexte de l’étude
Certains patients atteints de leucémie aiguë myéloblastique (LAM) et notamment les plus âgés, ne sont pas éligibles à un traitement intensif. Le pronostic de ces patients demeure sombre. Environ 6 à 10% des malades présentent une mutation de l’isocitrate deshydrogenase1 (IDH1), enzyme impliquée dans l’oncogenèse. L’ivosidenib inhibiteur d’IDH1, s’administrant par voie orale, s’est montré efficace dans ce contexte, en monothérapie (1) ou en association à l’azicitidine (2). En France, l’ivosidenib est actuellement disponible pour les patients atteints de LAM avec mutation IDH1 réfractaires ou en rechute.
Objectif de l’étude
L’étude AGILE est un essai randomisé de phase 3 contre placebo évaluant l’efficacité et la sécurité de l’association ivosidenib et azacitidine chez des patients atteints de LAM nouvellement diagnostiqués présentant une mutation IDH1 et non éligibles à une chimiothérapie intensive (≥ 75 ans ou présentant des comorbidités). Les patients étaient randomisés (1:1) et recevaient l’azacitidine (75 mg/m²/jour pendant 7 jours, tous les 28 jours) en association à l’ivosidenib 500 mg/jour ou à un placebo. Le critère de jugement principal était la survie sans événement (décès, rechute ou absence de rémission après 24 semaines de traitement).
Résultats de l’étude
De mars 2018 à mai 2021, 146 patients ont été randomisés : 72 dans le groupe azacitidine/ivosidenib et 74 dans le groupe contrôle, azacitidine/placebo. Les groupes étaient comparables. Une réponse complète (figure 1) était observée chez 47% des patients ayant reçu l’ivosidenib contre 15% dans le groupe placebo (p<0,001)

Figure 1 : réponses selon le groupe de traitement.
Après un suivi médian de 12, 4 mois la survie sans événement (figure 2, A) était supérieure pour le groupe expérimental (HR 0,33 ; IC95% : 0,16-0,69 ; p = 0,002). La survie globale (figure 2, B) était de 24 mois pour le groupe azacitidine/ivosidenib et de 7,9 mois pour le groupe azacitidine/placebo (hazard ratio 0,44 ; IC95%, 0,27-0,73; p = 0,001). Le taux d’infection (tous grades) dans le groupe expérimental était de 28% contre 49% dans le groupe placebo.
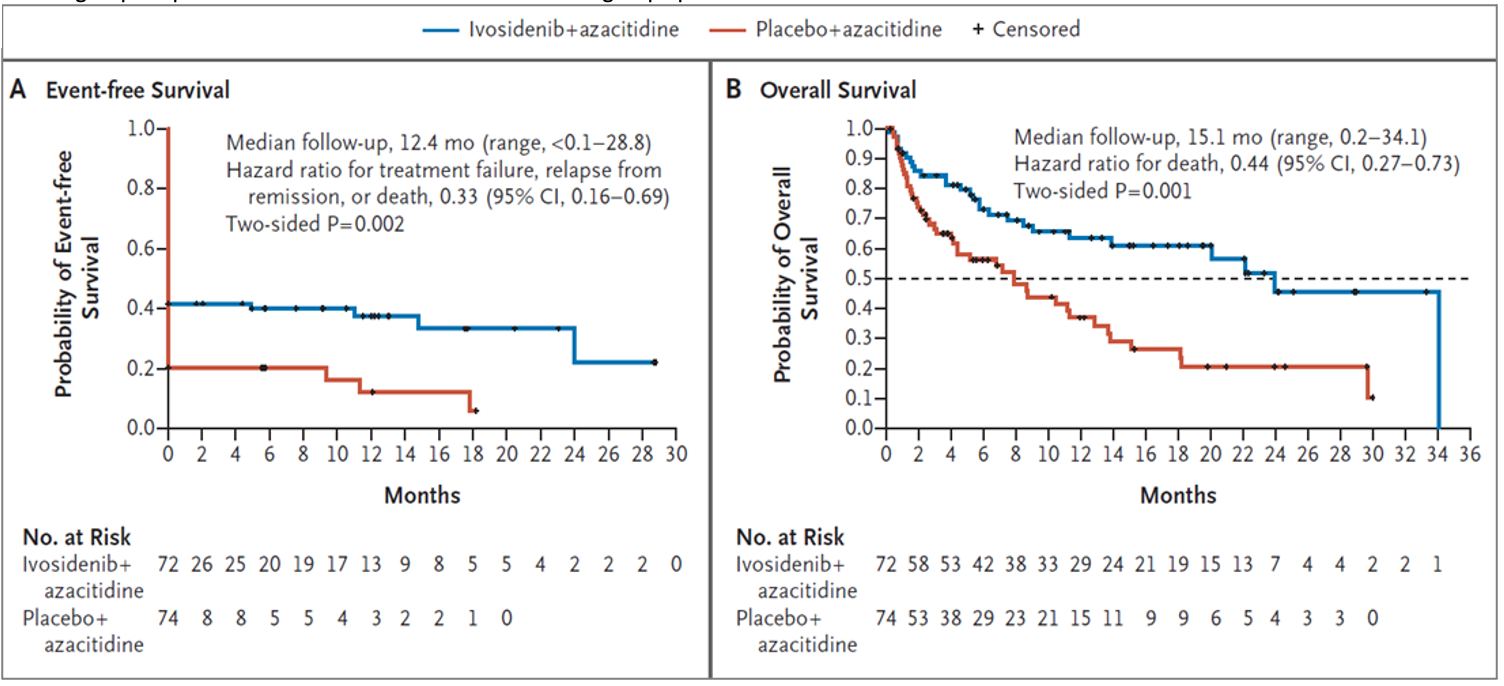
Figure 2 : survie sans événement et survie globale
Quels impacts sur les connaissances et les pratiques cliniques ?
L’interprétation des données de cet essai de phase 3 randomisée est rendue difficile par l’arrivée de l’association azacitidine et venetoclax pour les patients non éligibles à un traitement intensif (étude VIALE-A (3) ) pendant la phase de recrutement des patients rendant le bras de référence utilisé sous-optimale.
Toutefois, cette étude montre que l’association azaciditine/ivosidenib est faisable dans une population âgée, non éligibles à une chimiothérapie intensive.
Les effets secondaires correspondent globalement à ceux observés avec l’azacitidine seule et dominés par les complications infectieuses et les cytopénies.
De futurs travaux devront permettre de clarifier la place de l’ivosidenib dans la séquence thérapeutique. D’autres associations sont aussi à l’étude (ivosidenib et chimiothérapie intensive ou ivosidenib et venetoclax).
Critique méthodologique
Cet essai de phase III randomisé (avec stratification sur le type de LAM et le lieu géographique) multi-centrique (couvrant tout le globe de – liste non-exhaustive – Taïwan à l’Espagne en passant par la France, Australie et Etats-Unis) testant azaciditine/ivosidenib versus azaciditine/placebo a été réalisé en double-aveugle, soit le gold standard en matière d’essai clinique.
Le critère principal de cet essai est la survie sans événement (EFS), avec dans la définition de des événements : le décès, la rechute et l’absence de réponse complète (CR) à 24 semaines. L’objectif initial au moment de la création de cette étude était la survie globale comme critère primaire mais compte tenu de la rareté de la population et pour ne pas peiner le recrutement, l’EFS a été mis en avant car elle permet de capturer plus d’événements, et plus il y a d’événements potentiels, moins il y a besoin de patients à inclure. L’hypothèse formulée pour l’EFS était donc une amélioration pour le bras ivosidenib vs. placebo avec la prévision d’un hazard-ratio de 0.76 et de 173 événements. La survie globale a été reclassée en troisième critère à analyser, la réponse complète à 24 mois étant le second. Vous l’aurez compris, la liste des critères à analyser a été hiérarchisée et l’allocation du risque alpha a été appliquée selon ce procédé suivant la fonction de O’Brien-Fleming (avec méthode Lan-Demets). Autre modification du protocole : l’arrêt prématuré de l’étude par le sponsor après 73 événements de décès (stoppant l’inclusion à 146 patients au lieu des 200 prévus) alors que les analyses intérimaires prévues dans les premières versions du protocole ont été supprimées. Les seuils de p-values respectifs à chaque critère à évaluer ont alors été recalculés en conséquence.
L’étude conclut donc à l’amélioration de l’EFS avec un HR de 0.33 [IC 95% 0.16-0.69] avec une p-value de 0.002 (soit inférieure au seuil de 0.009 qui a été calculé par la fonction d’O’Brien-Fleming). C’est deux fois mieux que prévu ! Evidemment les courbes d’EFS démarrent autour de 40% et 20% de probabilités de survie respectivement pour ivosidenib et placebo, cette « cassure » étant provoquée par la prise en compte du taux de réponse à 24 semaines post-randomisation. Le risque de décès est plus que divisé par deux pour le bras ivosidenib (HR = 0.44), avec une médiane de survie de 24 mois contre 7.9 pour le bras avec placebo (3 fois plus longtemps donc pour le bras ivosidenib !) et là aussi la p-value de 0.001 était inférieure au seuil fixé (0.003). D’autres points-clefs secondaires ont été successivement vérifiés (durée de réponse notamment).
Un forest-plot vient synthétiser les analyses en sous-groupes sur l’EFS, démontrant l’amélioration de la survie sans événement avec le nouveau traitement dans beaucoup de sous-groupe, sauf chez les patients avec un risque cytogénétique défavorable et les populations blanches et asiatiques (qui sont les moins représentées dans cette étude internationale qui couvre quasi le monde entier).
| Points forts | Points faibles | |
| Cliniques
|
|
|
| Statistiques
|
|
|
Sources :
- Popovici-Muller J, Lemieux RM, Artin E, Saunders JO, Salituro FG, Travins J, et al. Discovery of AG-120 (Ivosidenib): A First-in-Class Mutant IDH1 Inhibitor for the Treatment of IDH1 Mutant Cancers. ACS Med Chem Lett. 12 avr 2018;9(4):300‑5.
- DiNardo CD, Stein AS, Stein EM, Fathi AT, Frankfurt O, Schuh AC, et al. Mutant Isocitrate Dehydrogenase 1 Inhibitor Ivosidenib in Combination With Azacitidine for Newly Diagnosed Acute Myeloid Leukemia. J Clin Oncol Off J Am Soc Clin Oncol. 1 janv 2021;39(1):57‑65.
- DiNardo CD, Jonas BA, Pullarkat V, Thirman MJ, Garcia JS, Wei AH, et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid Leukemia. N Engl J Med. 13 août 2020;383(7):617‑29.
Leave A Comment